La UE aprueba la primera terapia dirigida al cáncer de pulmón con mutaciones: ¿cuándo llegará a España?
La innovación llega con 600 días de media a nuestro país
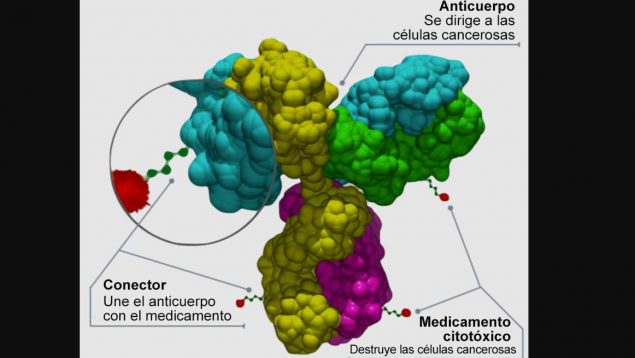
El tratamiento es un anticuerpo conjugado dirigido específicamente a HER2
Este año se van a diagnosticar más de 28.000 casos de cáncer hematológico en España

Fact checked
Este artículo de OkSalud ha sido verificado para garantizar la mayor precisión y veracidad posible: se incluyen, en su mayoría, estudios médicos, enlaces a medios acreditados en la temática y se menciona a instituciones académicas de investigación. Todo el contenido de OkSalud está revisado pero, si consideras que es dudoso, inexacto u obsoleto, puedes contactarnos para poder realizar las posibles modificaciones pertinentes.
La Unión Europea ha aprobado para su comercialización, en el conjunto de los Estados miembro, deruxtecán, un tratamiento contra el cáncer de pulmón no microcítico avanzado HER2 mutado para el que, hasta ahora, no había muchas alternativas terapéuticas. Y es que, este tipo de tumores afectan en un alto porcentaje a jóvenes y más a mujeres que a hombres.
Sin embargo, la pregunta es cuándo será aprobado por las autoridades españolas, teniendo en cuenta que los tiempos que el Ministerio de Sanidad maneja para la aprobación de innovación contra el cáncer supera la barrera de los 600 días.
Cada vez más, las personas con cáncer de pulmón reciben tratamientos que se concentran en cambios genéticos específicos en sus tumores (terapias dirigidas). Ahora los pacientes de cáncer de pulmón de células no pequeñas (CPCNP) tienen otra opción de terapia dirigida.
El cáncer de pulmón es el segundo tipo de cáncer más frecuente en todo el mundo, con más de dos millones de casos diagnosticados en 2020. En Europa, el tumor pulmonar es el tercero más diagnosticado, con más de 477.000 casos diagnosticados en 2020. Esta enfermedad es también la principal causa de muerte relacionada con el cáncer en Europa, con casi 400.000 muertes en 2020. El pronóstico es particularmente malo para los pacientes con CPNM metastásico, ya que sólo aproximadamente el 9% vivirá más de cinco años después del diagnóstico.
El Profesor Martin Reck, MD, Jefe del Departamento de Oncología Torácica de la Clínica Pulmonar Grosshansdorf (Alemania), ha señalado que «el cáncer de pulmón no microcítico HER2 mutado se diagnostica con mayor frecuencia en pacientes jóvenes y de sexo femenino, y las opciones de tratamiento son limitadas, lo que a menudo se traduce en un mal pronóstico».
«Este anticuerpo conjugado constituye la primera terapia dirigida a HER2 (ADC) que ha demostrado resultados en estos pacientes, y esta aprobación en la UE supone un importante paso adelante en el tratamiento de la enfermedad», ha asegurado.
«Desde su aprobación inicial para el cáncer de mama metastásico en la UE hace más de dos años, hemos mantenido nuestro compromiso de llevar este innovador anticuerpo conjugado a más pacientes con tumores accionables para HER2, especialmente a aquellos que anteriormente no han sido elegibles para el tratamiento con una terapia dirigida a HER2», señala Ken Keller, director Global del Negocio de Oncología, y Presidente y CEO de Daiichi Sankyo.
Terapia sistémica
Daiichi Sankyo y AstraZeneca han anunciado que trastuzumab deruxtecán, registrado como Enhertu, ha sido aprobado en la Unión Europea como monoterapia para el tratamiento de pacientes adultos con cáncer de pulmón no microcítico (CPNM) avanzado cuyos tumores presentan una mutación activadora de HER2 (ERBB2) y que requieren terapia sistémica tras quimioterapia basada en platino con o sin inmunoterapia.
El tratamiento es un anticuerpo conjugado dirigido específicamente a HER2 que está siendo desarrollado y comercializado conjuntamente por ambas compañías. La aprobación por parte de la Comisión Europea llega tras la opinión positiva del Comité de Medicamentos de Uso Humano y está basada en los resultados del ensayo de fase II DESTINY-Lung02, que se presentaron en el Congreso Mundial de Cáncer de Pulmón (IASLC) y publicaron en Journal of Clinical Oncology.
En el ensayo, este ADC (5,4 mg/kg) demostró, en la variable principal del estudio, una tasa de respuesta objetiva (TRO) confirmada del 49,0% en pacientes con CPNM avanzado o metastásico HER2 previamente tratados, según un comité ciego de revisión central independiente (BICR). Se observó una respuesta completa (RC) (1,0%) y 49 respuestas parciales (RP) (48,0%). La mediana de la duración de la respuesta (DDR) fue de 16,8 meses.
«Con la noticia de hoy, nuestro ADC se convierte en el primer anticuerpo conjugado aprobado para el cáncer de pulmón en la UE y ahora está aprobado en tres tipos de tumores diferentes».
El vicepresidente Ejecutivo de la Unidad de Negocio de Oncología de AstraZeneca, Dave Fredrickson, señala por su parte que «comprender los marcadores moleculares que subyacen a un diagnóstico de cáncer de pulmón es fundamental, y aunque ahora existen terapias dirigidas para muchos pacientes, aquellos con cáncer de pulmón no microcítico avanzado HER2 mutado han tenido pocas opciones de tratamiento, ninguna de las cuales ha sido aprobada para tratar su tipo específico de cáncer de pulmón»,









